S. Casano, G. Grassi, V. Martini and M. Michelozzi (2011)
Variations in terpene profiles of different strains of Cannabis sativa L. Acta Horticulturae 925:115-121
Los compuestos causantes de los efectos psicotrópicos del Cannabis, como es su principal cannabinoide psicotrópico Δ9-THC (delta9-tetrahydrocannabinol), han sido ampliamente estudiados por su posible utilidad en aplicaciones medicinales. La industria farmaceútica, sin embargo, está interesada en la planta como una fuente de materia prima y estudia la variabilidad y sinergia entre los variados metabolitos secundarios. Otros cannabionides, terpenoides y flavonoides pueden reducir la anxiedad, el déficit colinérgico y la inmunosupresión provocada por el Δ9-THC, a la vez que incrementar el flujo sanguíneo cerebral, mejorar la actividad cortical, acabar con patógenos respiratorios y actuar como antiinflamatorios (McPartland y Russo, 2001). Los terpenoides poseen un amplio rango de propiedades biológicas, incluyendo entre ellas efectos quimiopreventivos contra el cáncer y mejora de la penetración de la piel, así como actividad antimicrobiana, antifúngica, antiviral, antihiperglicémica, antiinflamatoria y antiparasitaria (Paduch et al., 2007).
Las plantas presentan cambios bioquímicos dinámicos cuando son atacadas por enfermedades y herbívoros, así como en respuesta al estrés abiótico, dando esto lugar a la producción inducida y liberación de compuestos volátiles del aroma beneficiosos para la defensa directa o indirecta de la planta. En la Arabidopsis thaliana (Huang et al., 2010) y la Medicago truncatula (Navia-Ginè et al., 2009) se produce una significativa variación cuantitativa en la emisión del monoterpeno trans-β-ocimeno como consecuencia del ataque de insectos herbívoros. Dos monoterpenos que suelen estar presentes entre los compuestos volátiles del aroma del Cannabis, limoneno y α-pineno, al igual que otros monoterpenes, han demostrado ser un fuerte repelente de insectos herbívoros (Nerio et al., 2010), mientras que los sesquiterpenes tienden a ser relacionados con la ingesta por parte de animales herbívoros. Potter (2009) demostró que, en el Cannabis, la propoción monoterpeno:sesquiterpeno existente en las hojas e inflorescencias es muy diferente debido a la presencia dominante de tricomas sésiles en el follaje, y de tricomas capitados pedunculados en el material floral, con los monoterpenos más volátiles dominando en las hojas para actuar como antiherbívoros para animales herbívoros. Tratándose esta de un Cannabis de uso farmacéutico, es normalmente cultivado en instalaciones inaccesibles para animales herbívoros, manteniéndose como el mayor problema el de los insectos herbívoros, especialmente los más comunes y destructivos como son la araña roja, los trips, y la mosca blanca. Por lo tanto, el análisis de monoterpenos y el estudio de su variabilidad podría jugar un papel estratégico en la selección de plantas menos susceptibles del ataque de estos y otros insectos.
Los terpenos son fuertemente heredados y poco influenciados por factores del entorno, por lo que han sido muy utilizados como marcadores bioquímicos en estudios quimiosistemáticos para definir especies de plantas, procedencia, clones e híbridos. Se ha constatado una gran variabilidad en el contenido de terpenos en diferentes cepas de Cannabis (Mediavilla y Steinemann, 1997; Novak et al., 2001; Hillig, 2004; Fischedick y et al., 2010). La variabilidad en el metabolismo secundario combinada con información genetica ha reabierto un antiguo debate sobre su enfoque taxonómico. De hecho, Hilling (2005) propuso un concepto politípico que reconoce tres especies (Cannabis sativa, Cannabis indica y Cannabis ruderalis) y siete supuestos taxones, pero la mayoría de los investigadores siguen apoyando el enfoque monotípico por el momento, e identifican las especies como Cannabis sativa L. La diferenciación de las cepas en ‘sativa pura’, ‘predominancia sativa’, ‘híbrido sativa/índica’, ‘predominancia índica’, ‘índica pura’ e ‘híbrido ruderalis’ es generalmente adoptada por cultivadores y productores para distinguir los diferentes biotipos. El presente estudio investigó la variabilidad en los perfiles de terpenes de cepas de Cannabis y exploró la utilidad de los monoterpenes en la distinción entre los biotipos de ‘predominancia sativa’ y ‘predominancia índica’.
Materiales y métodos
Se obtuvieron diferentes cepas con un perfil Δ9-THC de cultivadores de compañías privadas. La designación de cepas como biotipos de ‘predominancia sativa’ o ‘predominancia índica’ se basó en el historial genético aportado por los cultivadores. La designación de biotipos de ‘índica pura’ o ‘sativa pura’ no se puso en práctica por la falta de información sobre estas cepas. Cada cepa consistía en un pack comercial con, aproximadamente, diez semillas viables. Se realizaron evaluaciones preliminares sobre historial genético aportado plantando estas cepas durante la temporada de primavera-verano en un invernadero situado en CRA-CIN (Rovigo). Al principio de la etapa de floración se eliminaron las plantas estaminadas mientras que las plantas pistiladas fueron tratadas con una solución de tiosulfato de plata para inducir artificialmente la producción de inflorescencias estaminadas. Se produjo la autopolinización de todas las plantas pistiladas por medio del aislamiento de cada una de ellas con bolsas blancas de papel. Únicamente 16 plantas pistiladas derivadas de 16 cepas diferentes fueron finalmente seleccionadas. 8 plantas (ID: 5, 6, 7, 8, 9, 10, 11 y 12) fueron derivadas de cepas de ‘predominancia sativa’ y otras 8 (ID: 2, 3, 4, 13, 14, 15, 16 y 17) de cepas de ‘predominancia índica’.
Las progenies de 16 plantas se cultivaron en interior en CRA-CIN (Rovigo). 99 plantas en total (de 3 a 7 plantas por cada cepa) se desarrollaron bajo lámparas de sodio a alta presión 600 W/m2 (Philips Son-T). El fotoperiodo se mantuvo en 18 horas de luz durante las primeras 4 semanas de cultivo, para después ser reducido a 12 horas hasta el momento de la cosecha. La temperatura y humedad relativa del aire fueron respectivamente mantenidas 25±3°C y 50-70%. Las plantas fueron cultivadas individualmente en macetas de 1.5-L, en finísima fibra de coco (CANNA B.V.), y fueron fertirrigadas diariamente por medio de un sistema de irrigación automático, con la dosis adecuada dependiendo de las necesidades. La solución de nutrientes utilizada (EC=1.7) se obtuvo mezclando partes iguales de Coco A y B (CANNA B.V.) con agua del grifo, y el nivel de pH se ajustó a 5.5. La fertirrigación fue interrumpida 2 semanas antes de la cosecha y las macetas fueron enjuagadas con agua del grifo con un pH=5.5.
La cosecha de las primeras cepas (‘predominancia índica’) se produjo tras 105 días de la siembra, mientras que la cosecha de las más tardías (‘predominancia sativa’) no ocurrió hasta los 133 días. Tejidos frescos de inflorescencias de las plantas fueron muestreados durante la cosecha para el análisis de terpenoides. El material de muestra (80 mg tegidos frescos de inflorescencias) fue introducido en nitrógeno líquido, extraido en 4 ml de n-pentano y, posteriormente, 1 ml del extracto fue transferido a viales de GC. La composición de terpenos fue analizada por GC/FID. 28 compuestos en total fueron detectados, 15 de ellos completamente identificados y 13 permanecen aun sin identificar (desc.). Los terpenoides fueron identificados tras hacer corresponder sus tiempos de retención con los de compuestos puros bajo las mismas condiciones. Dependiendo de sus tiempos de retención, los máximos fueron identificados como α-pineno, desc.1, desc.2, canfeno, β-pinen0, sabinene, Δ-3-careno, α-felandreno, β-mirceno, α-terpineno, limoneno, 1.8 cineole, γ-terpinene, cis-β-ocimeno, trans-β-ocimeno, α-terpinoleno, desc.3, desc.4, β-cariofileno, desc.5, desc.6, desc.7, desc.8, desc.9, desc.10, desc.11, desc.12 y desc.13. Los terpenos identificados fueron en su mayoría monoterpenos, con la excepción de un sesquiterpeno, el β-cariofileno.
El contenido relativo de cada monoterpeno fue expresado como un porcentaje del total de monoterpenos, mientras que cada sesquiterpeno fue calculado como un porcentaje del total de monoterpenos y sesquiterpenes. La información no fue tratada del modo más habitual (Kolmogorov-Smirnov One-Sample Test), sino que fue analizada por el ANOVA no paramétrico de Kruskal-Wallis, seguido por el Test U de Mann-Whitney para obtener así múltiples comparativas. Las diferencias se definieron como significativas a un nivel del 5%. Análisis estadísticos fueron llevados a cabo con el software SYSTAT 12.0 (Systat Software Inc., USA).
Discusión de los resultados
El contenido relativo de terpenoides es fuertemente heredado mientras que la producción total por peso del tejido está más sujeta a factores del entorno. La expresión de la composición basada en un tegido (mg/g) es usada para el control de calidad y la estadarización de las variedades de Cannabis cultivadas, así como para estudios quimiosistemáticos (Fischedick et al., 2010), pero el contenido relativo (%) de terpenoides es más utilizado para estudios quimiosistemáticos.
El promedio de contenidos relativos de compuestos dominantes detectados en los compuestos volátiles del aroma fue: β-mirceno (46.1±2.6%), α-pineno (14.0±1.5%), α-terpinoleno (10.2±1.8%), limoneno (7.3±1.3%), trans-β-ocimeno (6.6±0.7%), β-pineno (6.1±0.4%), α-terpineno (3.6±1.0%), β-cariofileno (1.2±0.2%), 1.8 cineol (1.1±0.2%), α-felandreno (0.7±0.1%) y Δ-3-careno (0.6±0.1%). El promedio de contenidos relativos de canfeno, desc.1, cis-β-ocimeno, desc.5, desc.8, desc.7, desc.13, sabinene, γ-terpineno, desc.3, desc.4, desc.6, desc.10, desc.2, desc.9, desc.11 y desc.12 fue inferior a 0.5%.
Los resultados del ANOVA de Kruskal-Wallis ANOVA entre diferentes cepas (d.f.=15, N=99) mostraron cambios significativos en los contenidos relativos de todos los compuestos: α-pineno (X2=71.6, P<0.001), desc.1 (X2=71.5, P<0.001), desc.2 (X2=43.6, P<0.001), canfeno (X2=67.2, P<0.001), β-pineno (X2=53.2, P<0.001), sabinene (X2=72.5, P<0.001), Δ-3-careno (X2=69.4, P<0.001), α-felandreno (X2=59.6, P<0.001), β-mirceno (X2=47.7, P<0.001), α-terpineno (X2=36.3, P<0.01), limoneno (X2=77.1, P<0.001), 1.8 cineol (X2=67.5, P<0.001), γ-terpineno (X2=30.9, P<0.01), cis-β-ocimeno (X2=79.5, P<0.001), trans-β-ocimeno (X2=82.1, P<0.001), α-terpinoleno (X2=78.7, P<0.001), desc.3 (X2=37.6, P<0.001), desc.4 (X2=33.7, P<0.01), β-cariofileno (X2=55.7, P<0.001), desc.5 (X2=65.6, P<0.001), desc.6 (X2=74.4, P<0.001), desc.7 (X2=50.1, P<0.001), desc.8 (X2=64.7, P<0.001), desc.9 (X2=63.2, P<0.001), desc.10 (X2=61.1, P<0.001), desc.11 (X2=80.1, P<0.001), desc.12 (X2=61.8, P<0.001) y desc.13 (X2=52.8, P<0.001).
El β-mirceno fue detectado en un alto porcentaje en todas las cepas, siendo la cepa 17 la de mayor contenido relativo (80.1±7.3%) y la 8 la de menor (16.1±3.4%) (Tabla 1). El β-mirceno fue el terpeno dominante en casi todas las cepas a excepción de las cepas 6, 7, 8 y 12. El α-terpinoleno fue detectado en un alto porcentaje en algunas cepas de ‘predominancia sativa’ (7, 8, 9, 10 y 12), con las cepas 7 y 8 con este como terpeno dominante (41.8±7.2% y 37.3±3.5% respectivamente), mientras que no apareció o apareció vagamente en cepas de ‘predominancia índica’ y en algunas de ‘predominancia sativa’ (5, 6 y 11). El α-pineno y el β-pineno fueron detectados en todas las cepas y sus contenidos relativos fueron inferiores al 10%. El α-pineno apareció en contenidos relativos mayores (hasta un 10%) en algunas cepas (3, 6, 8, 11, 12, 14, 15 y 16), mostrándose en las cepas 6 y 12 como el terpeno dominante (46.3±5.7% y 24.2±15.6% respectivamente). El β-pineno fue detectado en mayores contenidos relativos (hasta un 10%) en las cepas 3 (12.6±1.6%) y 6 (13.2±0.8%). El limoneno se manifestó en porcentajes inferiores o apareció levemente en algunas cepas de ‘predominancia índica’ (3, 14, 15 y 16) y en algunas de ‘predominancia sativa’, mientras que fue localizado en porcentajes mucho mayores (hasta un 10%) en otras cepas de ‘predominancia índica’ (2, 4, 13 y 17), las cuales mostraron el limoneno como su segundo terpenoide más abundante. El Trans-β-ocimeno no fue detectado o fue detectado en bajos porcentajes en una cepa de ‘predominancia sativa’ (6) y en cepas de ‘predominancia índica’, mientras que apareció en mucho mayores porcentajes en otras cepas de ‘predominancia sativa’ (5, 7, 8, 9, 10, 11 y 12) (hasta un 5%), teniéndolo las cepas 5 y 11 como su terpenoide más abundante (18.7±1.9% y 16.8±2.2% respectivamente). El α-terpineno fue detectado levemente o en bajos porentajes en la mayoría de las cepas, destacándose la cepa 4 por tener un mucho mayor contenido relativo del mismo (18.0±8.0%). El sesquiterpeno β-cariofileno fue detectado en todas las cepas y su contenido relativo apareció mayoritariamente en porcentajes inferiores al 2%, aunque mostró contenidos relativos en algunas cepas (2, 9, 13 y 17) de hasta el 2%. 1.8 cineol apareció en bajos porcentajes (hasta un 2%) en algunas cepas de ‘predominancia sativa’ (7, 8, 9, 10 y 12), mientras que fue detectado levemente o en bajos porcentajes en cepas de ‘predominancia índica’ y en algunas otras de ‘predominancia sativa’ (5, 6 y11). Tanto el Δ-3-careno como el α-felandreno se mostraron en bajos porcentajes (hasta un 1%) en algunas cepas de ‘predominancia sativa’ (7, 8, 9, 10 y 12), mientras que no aparecieron en cepas de ‘predominancia índica’ ni en algunas de ‘predominancia sativa’ (5, 6 y 11).
El Test U de Mann-Whitney realizado entre cepas de ‘predominancia sativa’ y ‘predominancia índica’ (d.f.=1, N=99) reveló cambios significativos en contenidos relativos de diferentes compuestos a excepción de en α-pineno, desc.2, β-pineno, α-terpineno, γ-terpineno, β-cariofileno, desc.7, desc.12 y desc.13 (Fig. 1). Los contenidos relativos de canfeno (X2=22.7, P<0.001), β-mirceno (X2=23.1, P<0.001), limoneno (X2=27.8, P<0.001), desc.3 (X2=15.4, P<0.001), desc.6 (X2=29.9, P<0.001) y desc.11 (X2=42.3, P<0.001) fueron significativamente superiores en las cepas de ‘predominancia índica’ que en las de ‘predominancia sativa’ (Fig. 1). Las plantas provenientes de las cepas de ‘predominancia sativa’ mostraron propociones notablemente superiores de desc.1 (X2=33.4, P<0.001), sabinene (X2=24.9, P<0.001), Δ-3-careno (X2=39.6, P<0.001), α-felandreno (X2=31.97, P<0.001), 1.8 cineol (X2=19.2, P<0.001), cis-β-ocimeno (X2=48.6, P<0.001), trans-β-ocimeno (X2=52.6, P<0.001), α-terpinoleno (X2=13.2, P<0.001), desc.4 (X2=15.3, P<0.001), desc.5 (X2=29.6, P<0.001), desc.8 (X2=24.3, P<0.001), desc.9 (X2=7.5, P<0.01) y desc.10 (X2=9.5, P<0.01) que las de las encontradas en las provenientes de las cepas de ‘predominancia índica’ (Fig. 1).
Aunque Hillig (2004) afirmó que las diferencias de terpenoides en la Cannabis son de utilidad limitada para el criterio taxonómico a niveles de especies, con los sesquiterpenes generalmente más útiles que los monoterpenos, hemos encontrado que varios monoterpenos pueden servir como potentes herramientas para discernir entre biotipos de ‘predominancia sativa’ y ‘predominancia índica’ (Tabla 1 y Fig. 1). Nuestras conclusiones se apoyan también en resultados recientes obtenidos por Fischedick et al. (2010), que muestran que los monoterpenes pueden ayudar a distinguir entre variedades con similares sesquiterpenos y niveles de cannabinoides.
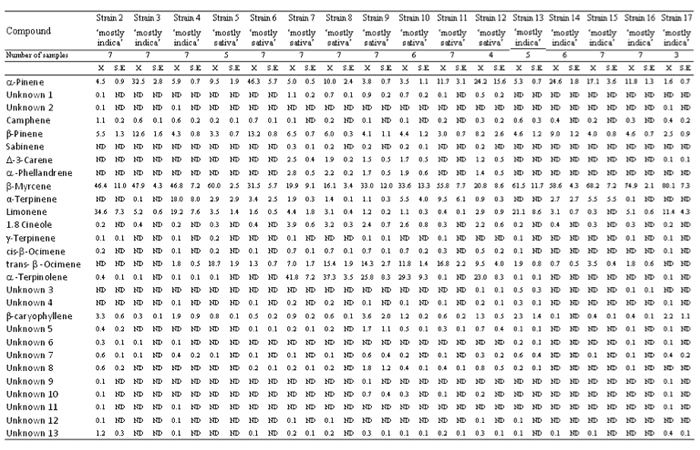
Tabla 1. Perfiles de terpenos de diferentes cepas de ‘predominancia índica’ y ‘predominancia sativa’ de Cannabis sativa L.
ND = no detectado
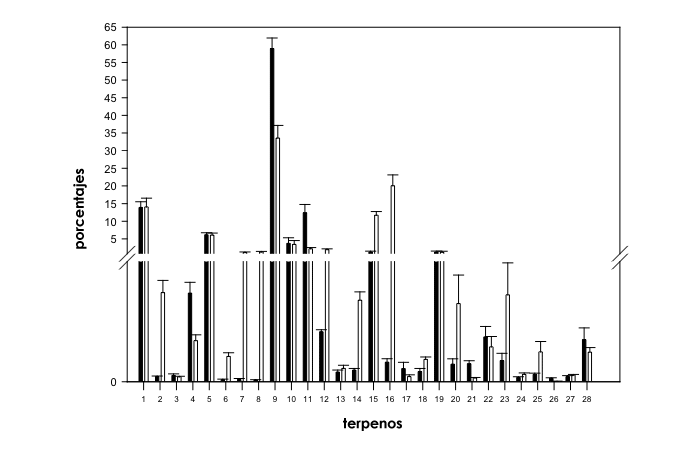
Fig. 1. Comparativa de perfiles de terpenos en cepas de Cannabis sativa L. de ‘predominancia índica’ (histogramas negros) y ‘predominancia sativa’ (histogramas blancos). El corte en el eje Y se situa en 0.7-0.8. Los números en el eje X hacen referencia a los siguientes compuestos individuales: 1=α-pineno, 2=desc.1, 3=desc.2, 4=canfeno, 5=β-pineno, 6=sabinene, 7=Δ-3-careno, 8=α-felandreno, 9=β-mirceno, 10=α-terpineno, 11=limoneno, 12=1.8 cineol, 13=γ-terpineno, 14=cis-β-ocimeno, 15=trans-β-ocimeno, 16=α-terpinoleno, 17=desc.3, 18=desc.4, 19=β-cariofileno, 20=desc.5, 21=desc.6, 22=desc.7, 23=desc.8, 24=desc.9, 25=desc.10, 26=desc.11, 27=desc.12 y 28=desc.13.
Conclusiones
Las principales diferencias entre los perfiles de terpenos de las cepas evaluadas de los dos biotipos principales fueron que las cepas de ‘predominancia índica’ se caracterizaban por la dominancia de β-mirceno, presente en altos contenidos relativos, con el limoneno o el α-pineno como los segundos terpenoides más abundantes, mientras que las cepas de ‘predominancia sativa’ se caracterizaban por tener perfiles de terpenos más complejos, con algunas cepas manifestando el α-terpinoleno o el α-pineno como los terpenoides dominantes, y algunas cepas con el β-mirceno como el terpenoide dominante y el α-terpinoleno o el trans-β-ocimeno como los terpenoides secundarios más abundantes.
Esta variabilidad en la composición de terpenos puede ser una potente herramienta para la calificación de biotipos de Cannabis, así como una garantía para futuros investigadores en la estimación del valor medicinal de los mismos, y, al mismo tiempo, en la selección de quimiotipos menos susceptibles del ataque de hervíboros y enfermedades, lo que constata la necesidad de una investigación más profunda sobre la variabilidad de monoterpenos y sesquiterpenos. El cultivo de plantas con terpenoides específicos es un tema de investigación fascinante; de hecho, las variadas actividades biológicas de estos compuestos hacen del análisis de los terpenoides una herramienta valiosa para la mejora de un número considerable de atributos en variedades de Cannabis farmacéuticas e industriales.
El análisis de terpenoides, combinado con el de cannabinoides y flavonoides, es esencial para la huella metabólica de variedades de cultivo farmacéuticas. Las variedades farmacéuticas de los dos biotipos principales pueden mostrar inconfundibles propiedades medicinales debido a diferencias significativas en sus contenidos relativos de terpenoides, por lo que la sinergia entre los variados metabolitos secundarios debe ser investigada en mayor detalle, para alcanzar una mayor claridad del fitocomplejo del Cannabis y permitir así la selección de quimiotipos con efectos medicinales determinados.
Agradecimientos
Agradecemos a Phytoplant Research S.L. su apoyo financiero.
Bibliografía citada
- Fischedick, J.T., Hazekamp, A., Erkelens, T., Choi, Y.H. and Verpoorte, R. 2010. Metabolic fingerprinting of Cannabis sativa L., cannabinoids and terpenoids for chemotaxonomic and drug standardization purposes. Phytochemistry 71:2058-2073.
- Hillig, K.W. 2004. A chemotaxonomic analysis of terpenoid variation in Cannabis. Biochemical Systematics and Ecology 32:875-891.
- Hillig, K.W. 2005. Genetic evidence for speciation in Cannabis. Genetic Resources and Crop Evolution 52:161-180.
- Huang, M., Abel, C., Sohrabi, R., Petri, J., Haupt, I., Cosimano, J., Gershenzon, J. and Tholl, D. 2010. Variation of herbivore-induced volatile terpenes among Arabidopsis ecotypes depends on allelic differences and subcellular targeting of two terpene synthases, TPS02 and TPS031. Plant Physiology 153:1293-1310.
- McPartland, J.M. and Russo, E.B. 2001. Cannabis and Cannabis extracts: greater than the sum of their parts? Journal of Cannabis Therapeutics 1:103-132.
- Mediavilla, V. and Steinemann, S. 1997. Essential oil of Cannabis sativa L. strains. Journal of the International Hemp Association 4:80-82.
- Navia-Ginéa, W.G., Yuanb, J.S., Mauromoustakosd, A., Murphye, J.B., Chenb, F. and Kortha, K.L. 2009. Medicago truncatula (E)-β-ocimeno synthase is induced by insect herbivory with corresponding increases in emission of volatile ocimeno. Plant Physiology and Biochemistry 47:416-425.
- Nerio, L.S., Olivero-Verbel, J. and Stashenko, E. 2010. Repellent activity of essential oils: a review. Bioresource Technology 101:372-378.
- Novak, J., Zitterl-Eglseer, K., Deans, S.G. and Franz, C.M. 2001. Essential oils of different cultivars of Cannabis sativa L. and their antimicrobial activity. Flavour and Fragrance Journal 16:259-262.
- Paduch, R., Kandefer-Szerszeń, M., Trytek, M. and Fiedurek, J. 2007. Terpenes: substances useful in human healthcare. Archivum Immunologiae et Therapiae Experimentalis 55:315-327.
- Potter, D. 2009. The propagation, characterisation and optimisation of Cannabis sativa L. as a phytopharmaceutical. Ph.D. Thesis in Pharmaceutical Sciences. Department of Pharmaceutical Science Research, King’s College, London.


